来源:小编 更新:2024-11-12 02:58:08
用手机看

电荷平衡,又称为电中性规则,是指在溶液化学平衡体系中,各种荷电型体所荷单位正电荷的总浓度必须等于所荷单位负电荷的总浓度。这一原理确保了溶液总是保持电中性,即溶液中的正电荷和负电荷数量相等,从而避免了电荷的不平衡导致的物理或化学现象。
电荷平衡的原理基于溶液中的离子平衡。在溶液中,阳离子(带正电荷)和阴离子(带负电荷)会根据其溶解度、溶解度积和反应平衡常数等因素进行动态平衡。根据电荷平衡原理,溶液中所有阳离子的正电荷总和必须等于所有阴离子的负电荷总和,以保证溶液的电中性。

电荷平衡原理在化学、生物学、环境科学等领域有着广泛的应用。
化学领域:在化学实验中,通过电荷平衡原理可以计算溶液中离子的浓度,从而了解溶液的性质和反应过程。
生物学领域:在生物体内,电荷平衡对于维持细胞内外环境的稳定至关重要。例如,细胞膜上的离子通道通过调节离子浓度来维持电荷平衡。
环境科学领域:在环境监测中,电荷平衡原理可以用于评估水体中的污染程度,如通过测定水体中的阳离子和阴离子浓度来判断水质。

在计算电荷平衡时,通常需要以下步骤:
列出溶液中所有阳离子和阴离子的种类及其浓度。
根据电荷平衡原理,列出电荷平衡方程式。
解方程式,求出未知离子的浓度。
以下是一个简单的电荷平衡实例:
在一个溶液中,已知Na+的浓度为0.1 mol/L,Cl-的浓度为0.2 mol/L,求OH-的浓度。
根据电荷平衡原理,溶液中的正电荷总和等于负电荷总和,即:
[Na+] + [H+] = [Cl-] + [OH-]
由于溶液呈中性,[H+]和[OH-]的浓度相等,即[H+] = [OH-]。
将已知浓度代入方程式,得:
0.1 + [H+] = 0.2 + [H+]
解方程式,得[H+] = [OH-] = 0.1 mol/L。
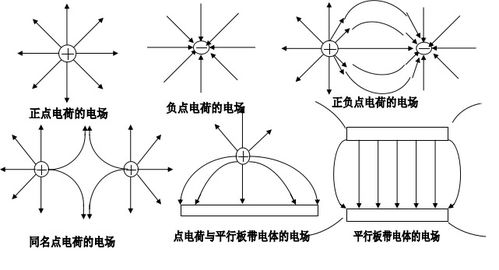
电荷平衡是维持溶液稳定性的关键因素。如果溶液中的电荷不平衡,可能会导致以下问题:
溶液性质的改变,如酸碱度的变化。
化学反应的异常进行。
生物体内环境的破坏。
因此,了解和掌握电荷平衡原理对于科学研究、工业生产和环境保护等领域具有重要意义。
电荷平衡是溶液化学中的一个基本原理,它确保了溶液的电中性,对于维持溶液的稳定性和进行相关科学研究具有重要意义。通过了解电荷平衡的原理和应用,我们可以更好地理解和控制溶液中的化学反应,为各个领域的发展提供有力支持。